活动回顾| 细胞基因治疗产品的质量管理2023年11月1日
随着细胞基因治疗领域快速发展,如何提高产品质量和管理水平越发重要。在“上海国际生物医药产业周之细胞与基因治疗新技术论坛”中,药明生基刘颖主任分享了细胞基因治疗产品的质量管理要点和相关经验,本文根据其演讲内容整理。

不同国家和地区对细胞基因治疗(CGT)产品的要求不尽相同。在中国,CGT产品注册已纳入药品管理体系,并按照治疗用生物制品分类。其最新法规体系从药学、临床、非临床等方面发布了相关的指导原则;欧盟对CGT产品(即先进治疗医疗产品,ATMPs)的法规主要在欧洲指令2001/83/EC(欧洲药品法规)及其修订版和欧洲条例(EC)No 1394/2007(ATMP法规)中阐述;FDA对CGT产品的法规主要包括产品定义、质量控制、上市许可、临床试验等方面。
基于以上各个国家对CGT产品的法规要求,药明生基建立了一套完善的质量管理体系,内容包括质量体系、物料体系、设备和设施、包装和标签、生产体系和实验室体系,这6大系统相辅相成,相互制约。同时药明生基还设计了质量管理的基本元素,包括质量管理评审、质量改进计划、纠正预防措施、变更管理、产品和工艺的系统绩效质量、质量风险管理和知识管理,来促进整个体系的持续改善。
CGT产品质量管理要点
01 污染和交叉污染
污染和交叉污染分为污染控制策略(CCS)、共线生产管理、无菌工艺模拟(APS)三部分。
污染控制策略是一项新的要求,对CGT产品来说是无菌保障的前提条件之一。药明生基的污染控制策略分三个阶段、24个模块进行了明确阐述。制定好CCS之后,需要按照该策略去评估现实的流程,设计,以及实际的操作细节,做出风险评估,并加以分析,然后制定相应的整改计划,制定文件以达到产品的无菌保障。策略性文件需要定期回顾,因为任何一个模块的变化都会影响整体控制策略。回顾,评估,整改,循环往复,才能持续保障产品的无菌性。
共线生产管理包括从设备、厂房和公用设施、流程、监控、物料和人员6个方面进行全面的风险评估,同时制定相应的管理要求。当有新产品引入时,共线生产会发起新的风险评估,并制定防交叉污染措施,确保新引入产品和原有产品之间没有共线生产的任何风险。
无菌工艺模拟是一项基本的要求原则。因为CGT产品的特殊性,大多数产品无法进行终端灭菌,因此需要全程的无菌生产技术。这就需要对整个生产过程进行无菌模拟,以证明确定的生产工艺能够持续且可重复的生产出符合要求的无菌产品。模拟过程一般采用无菌微生物生长培养基来挑战工艺,在GMP开始之前,需要有三批连续成功的APS来确认既定工艺的无菌保障水平,而且每6个月要重新验证APS。需要注意的是,APS之前的风险评估是非常重要的。
02 物料和供应商管理
物料引入管理:药明生基制定了非常详尽的物料管理流程,从所有的原辅料、包材和最终的内包材等物料范围着手,根据物料需求,寻找合适物料,并发起物料引入申请及评估,根据评估报告制定行动措施后,物料委员会审核引入评估。
物料分级及供应商审批:物料分级与供应商审批要相结合。物料引入评估程序完成后形成物料分级;同时还有物料供应商管理规程来规定供应商的分类管理,形成物料用途的风险等级,两种等级结合起来形成供应商审批等级。
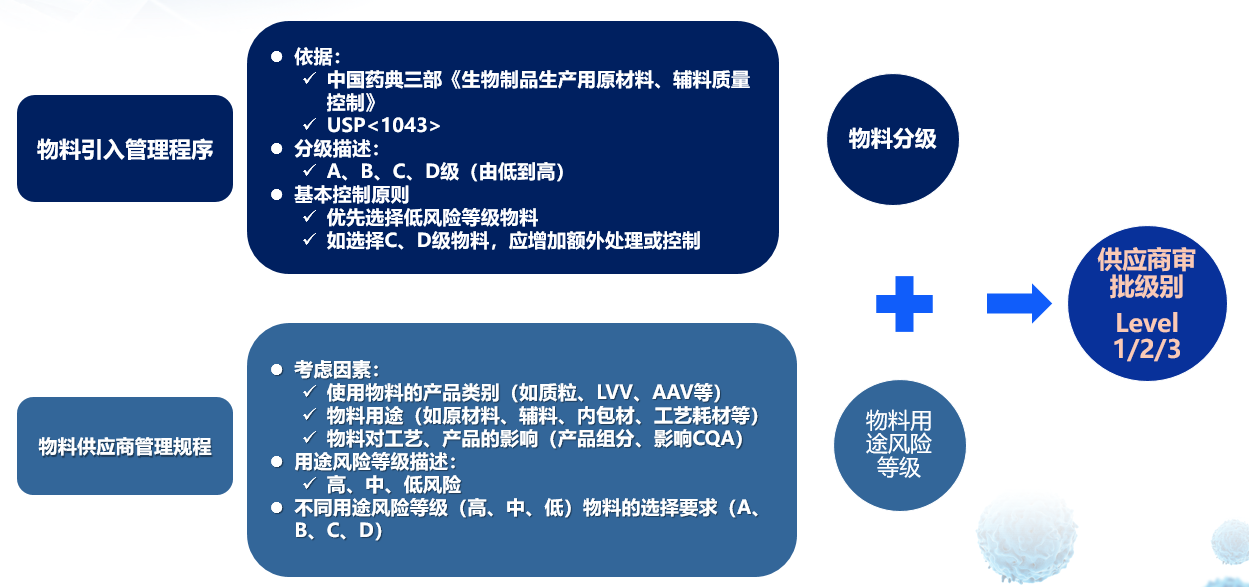 物料分级及供应商审批
物料分级分类管理策略,参考中国药典“生物制品生产用原材料及辅料质量控制”和《临床试验用药品(试行)》附录,临床试验申请到II期临床试验用物料为第一阶段,III期临床试验到上市许可阶段所用到的物料为第二阶段,进行分阶段区分管理。
如果项目一直从临床到上市,药明生基在内部流程中规定,从II期临床切换到III期临床,即从non-GMP到GMP阶段,需要发起变更评估,所有的物料、供应商等级,还有质量标准全部进行评估,将等级提高,全部符合GMP要求后才能够进入GMP生产。考虑到细胞库是从临床阶段用到上市许可阶段,建议从开始就用符合GMP要求的物料,以免在中途阶段有物料切换,造成重新评估甚至重新建库的风险。
03 数据可靠性管理
数据可靠性是永恒不变的话题,更是研发生产企业的生命线。药明生基数据可靠性管理遵循内部质量策略《数据完整性》和《数据可靠性行为守则》的指导,从人员、流程和技术三个方面来实现持续的改善,提高数据可靠性管理。对于计算机化系统生命周期管理,从系统的引入与验证,到系统放行和运维阶段,再到系统退役,均要制定相应的管理办法。下图为详细的计算机化系统管理和数据完整性管理文件及体系构建。
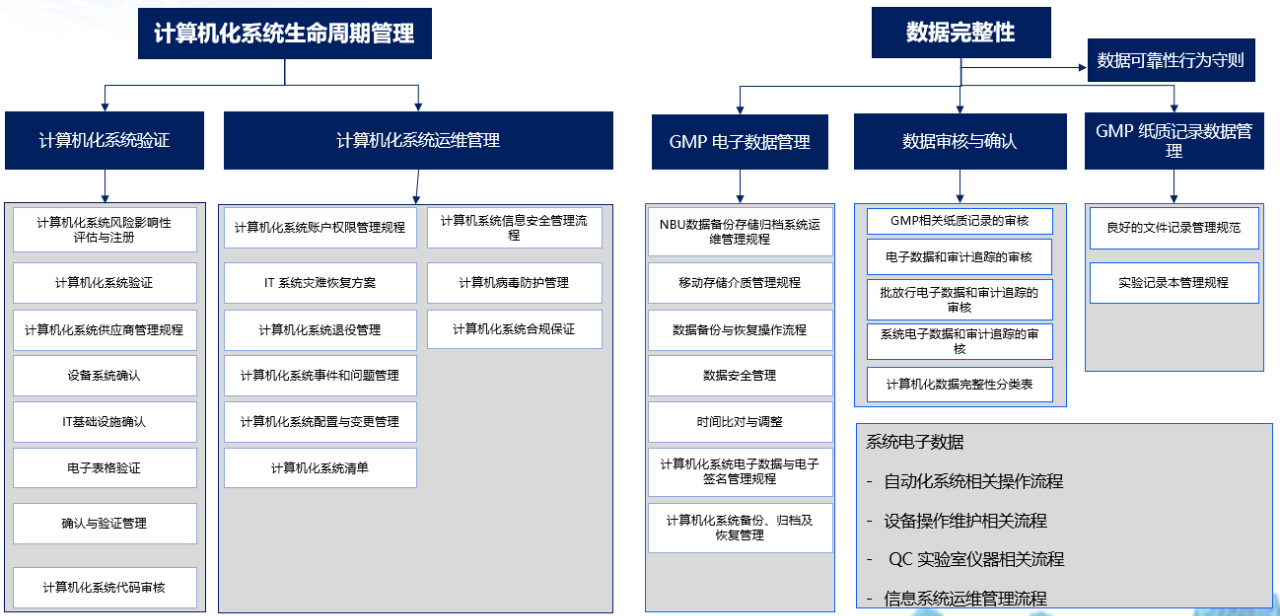 计算机化系统管理和数据完整性管理
结语
药明生基是药明康德旗下专注于细胞和基因疗法的CTDMO,致力于加速和变革细胞治疗、基因治疗及其他高端治疗的开发、测试、制造和商业化。药明生基在美国、英国、新加坡、上海外高桥、临港、及无锡惠山,都建设有基地,覆盖了细胞基因产品的研发、开发、测试及生产业务,国际标准的生产设施、灵活的产能布局以及全球统一的质量体系,可满足客户从临床前到商业化期间不同阶段的研发和生产需求。
如有业务洽谈,欢迎联系:
info_ATU@wuxiapptec.com。
|
